一文读懂:核酸检测之PCR技术
参考《新型冠状病毒肺炎诊疗方案(试行第七版)》(简称“《新冠诊疗方案第七版》”)的内容,新型冠状病毒(简称“新冠病毒”)属于β属的冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60~140 nm,遗传物质为单链核糖核酸。从审美角度来说,冠状病毒四周有放射状的突起,类似盔甲上的刺,形如日冕,具有一种“死亡美感”。
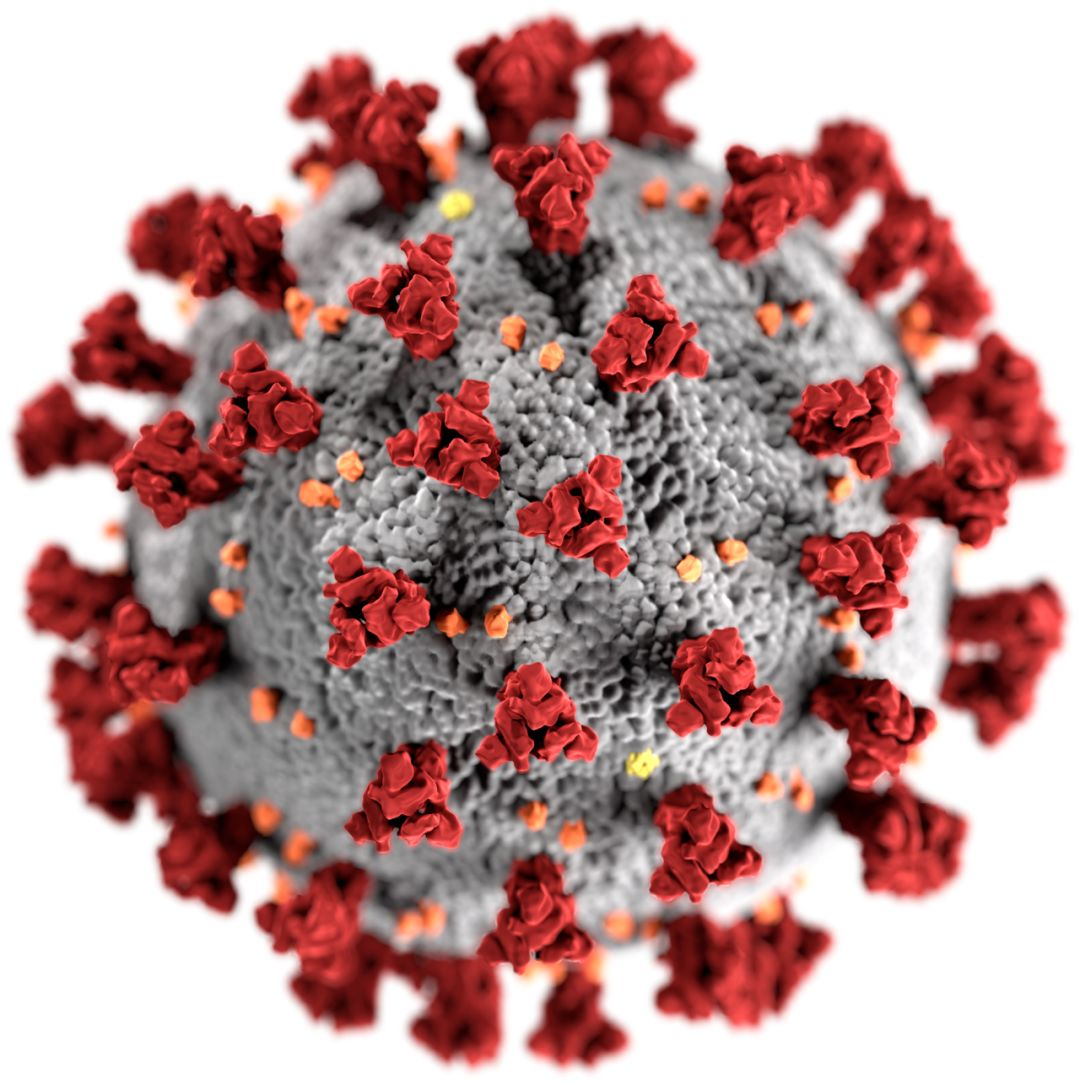
为了打赢抗击新冠病毒肺炎疫情这场战争,一个重要环节便是及早、准确地甄别并判定病毒感染者。《新冠诊疗方案第七版》中提及新冠病毒的检查包括病原学和血清学检查,其中病原学方法采用RT-PCR或/和NGS技术检测新冠病毒核酸,血清学方法采用免疫诊断技术检测新冠病毒的特异性IgM和IgG抗体。
截至2020年3月25日,国家药品监督管理局总计批准20个新冠病毒检测试剂,其中含有11个核酸检测试剂、8个抗体检测试剂、1个蛋白检测试剂。而第一批获批的新冠病毒检测试剂绝大多数为核酸检测方法,其中主要采用了荧光PCR法。由此可见,核酸检测(荧光PCR法)在此次抗击新冠病毒疫情中发挥了重要作用。
什么是核酸检测?什么是荧光PCR?为何可以作为新冠病毒确诊的“金标准”?荧光PCR在新冠病毒检测实战中面临怎样的挑战?
为了解答这些疑问,小编为大家简要介绍一下核酸检测中常用的荧光PCR技术。
(一)核酸是什么
核酸(nucleic acid),是一类由核苷酸(nucleotide)构成的生物大分子,分为核糖核酸(ribonucleic acid,RNA)和脱氧核糖核酸(deoxyribonucleic acid,DNA)两类,其中RNA多为单链结构,DNA多为双链结构。除朊病毒(prion)外,核酸是构成生命所必需的生物大分子,其主要作用是构成生命体的遗传信息载体,除此之外,还有部分核酸可作为及参与构成具有生物活性的酶分子或其他分子机器。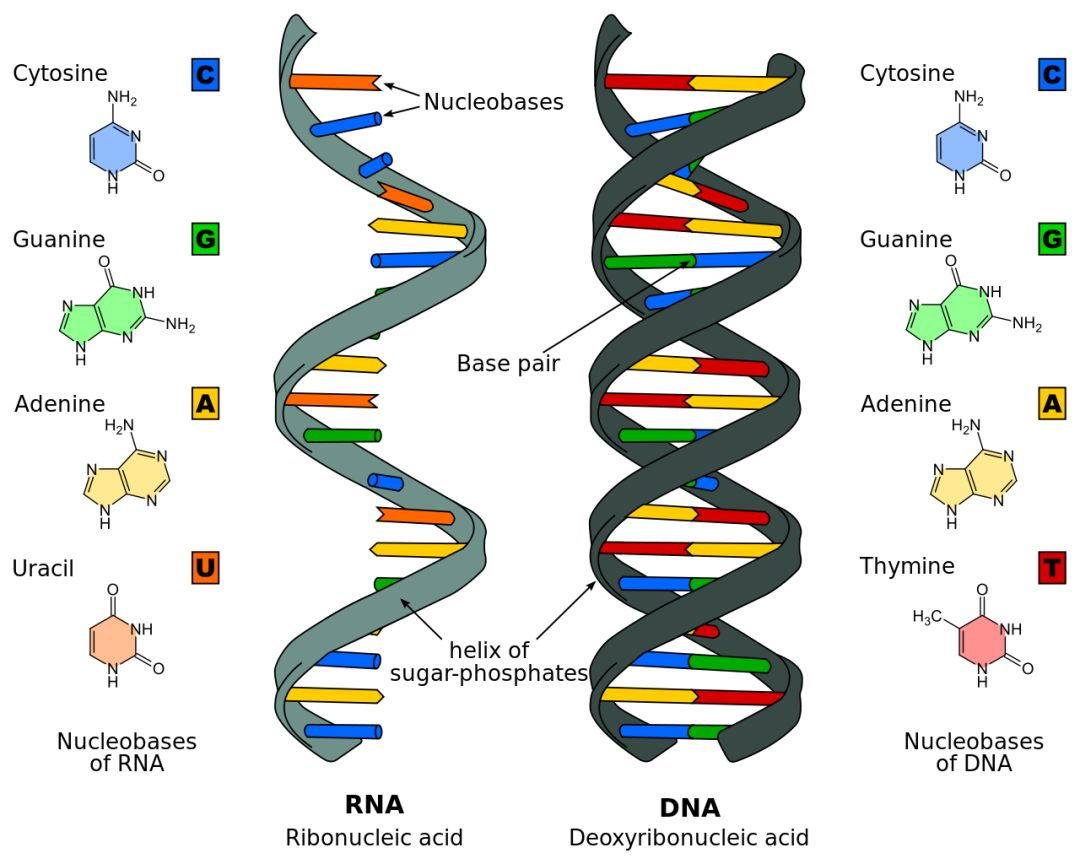
(二)核酸检测是什么
核酸检测顾名思义就是针对核酸开展检测。
核酸检测有何独特的优势呢?为何能作为新冠病毒确诊的“金标准”呢?
其实每一种检测方法都有其擅长的应用场景。以病毒检测为例,通常的免疫学检测方法(胶体金、ELISA、化学发光等)的检测对象是病毒的抗原或抗体,相当于“侧面描绘”。由于从感染到可检测存在一个时间窗口期,因此免疫学检测方法一般不合适作为早期诊断。
 补充知识:
补充知识:从机体对新冠病毒的体液免疫应答来看,新冠病毒的S蛋白、N蛋白等会刺激免疫系统引起抗体应答,随后出现IgM抗体、IgA抗体、IgG抗体。遵从急性感染的一般过程,当IgG抗体出现后,IgM持续降低直至消失,IgG浓度会持续增加并较长时间存于血清中。但是IgM和IgG需要感染一段时间后才会产生。
而核酸检测的检测对象是病毒的遗传物质,则是“正面追击”。理论上只要有一个病毒就可以检测到,因此核酸检测很合适作为早期诊断。而且核酸检测可以针对病毒遗传物质中特定的特异性区域,因此特异性很高,一旦检测到,则可以判断为阳性。
核酸检测主要包括核酸电泳、核酸杂交、聚合酶链式反应(polymerase chain reaction, PCR)、基因芯片、基因测序等。其中,PCR技术由于操作方便、可以快捷地获得定性或定量检测结果,是科研和临床中广为使用的一种核酸检测方法。
PCR技术由Kary Mullis于1988年首创,技术上实现了在体外模拟发生于细胞内的DNA快速扩增特定基因或DNA序列复制的过程。随着技术的发展,PCR已经衍生出很多不同的细分技术,例如quantitative PCR、multiplex-PCR,variable number of tandem repeats (VNTR) PCR,asymmetric PCR,nested PCR,touchdown PCR,digital PCR等等。
这么多技术,其实都绕不开最基本的PCR原理。
(一)PCR的基本过程
PCR一般会经历多轮温度循环,其中每一轮温度循环包括变性(denaturation)、退火(anealing)和延伸(elongation)三步。
变性是在高温(95℃左右)条件下,DNA模板双链打开的过程,使之能够与引物结合,为下面的反应做准备。退火是在冷却后(一般在68℃左右),变性后的DNA单链与引物通过碱基互补配对(A-T、C-G),再次形成局部双链。延伸是在DNA单链模板与引物特异性结合(俗称“接头”)之后,于72℃左右的温度下TaqDNA聚合酶发生作用,以脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate, dNTP,主要包括dATP、dUTP、dTTP、dCTP、dGTP)为原料,以靶向序列为模板,碱基互补配对为原则,再次合成完整的双链DNA的过程。经过延伸复制之后,有一条链是新合成的,另一条则是原有模板,于是此种复制方式称为半保留复制(semiconservative replication)。
通过多轮温度循环,初始少量的DNA模板以“一变二、二变四”这样的指数扩增方式,最终得到大量复制的DNA模板产物。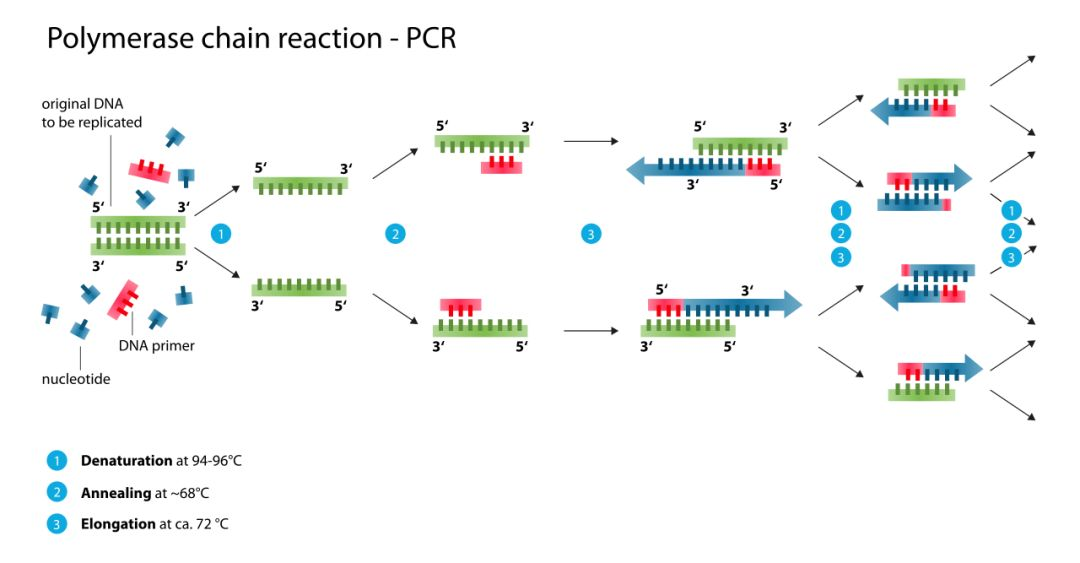
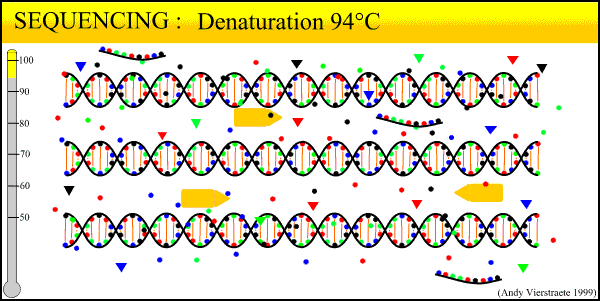
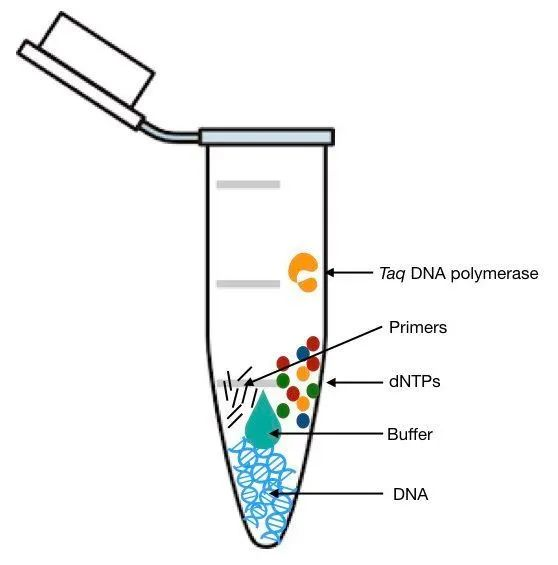
模板一般为DNA,有时也称底物。在检测过程中,首先使用提取/纯化试剂盒将血液等样品中的全部核酸给提取出来,而待检的DNA模板则“混迹”于其中。
引物通常是人工合成的两段寡核苷酸序列,其功能是作为核苷酸聚合作用的起始点,核酸聚合酶可由其3’-端开始合成新的核酸链。
dNTP主要包括dATP、dUTP、dTTP、dCTP、dGTP,dNTP是PCR扩增所需的基础原料。
DNA聚合酶是PCR反应中的关键成分,其主要在延伸步骤中发挥作用。由于PCR中的延伸步骤一般在72℃左右进行,因此反应体系中的DNA聚合酶需在该高温下仍保持高效的活性。筛选合适的酶对提升反应效率、节约反应时间是最为直接有效的手段。最经常使用的便是从水生栖热菌Thermus Aquaticus中分离出的具有热稳定性的DNA聚合酶,简称Taq酶。
缓冲液为反应提供了均质稳定的反应环境,成分较为复杂。主要包括缓冲体系、Mg2+、辅助成分(维持酶的活性)等。
PCR相当于一个“放大器”,让我们有能力检测到微量或痕量DNA的踪迹。但实际检测中,并非所有的待检样本为双链DNA,例如新冠病毒的遗传物质便是单链RNA。
此时对于这类单链RNA将如何检测呢?在“看到”模板是否存在的基础上,是否可以“测量”模板多少呢?
这便衍生出逆转录PCR(reverse transcription-PCR, RT-PCR)和实时荧光定量PCR(realtime-PCR,常简称为荧光PCR、缩写为qPCR)技术。
RNA是个单链,为了使用PCR手段对其进行检测,关键在于将RNA变成双链。
于是,RT-PCR则是先将单链RNA逆转录为双链cDNA(complementary DNA),然后再以cDNA为模板,历经PCR过程。
而realtime-PCR则实现了从定性检测向定量检测的飞跃。产生飞跃的关键因素,是在经典PCR中加入了荧光物质,通过实时检测荧光强度实现实时监测PCR过程(在一段区间范围内,荧光强度与模板数量呈正向线性关系)。根据荧光物质的特异性不同,可分为非特异性的荧光染料以及特异性的荧光探针两大类。
随着PCR的进行,可以绘制得出荧光信号强度随循环次数(测试时间)的一条曲线。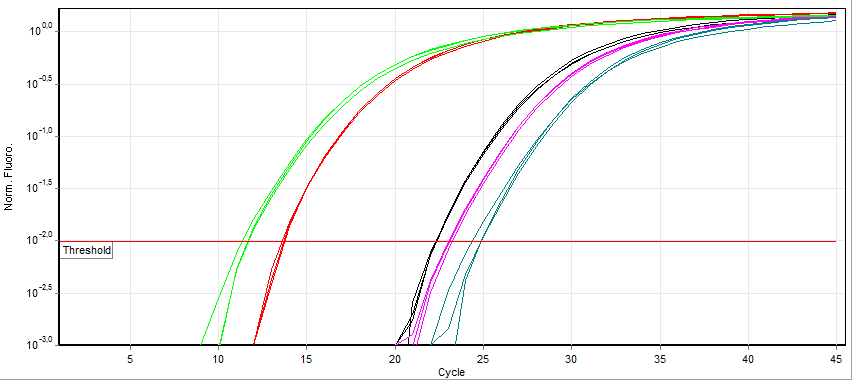
 有兴趣的可以看以下推导过程:
有兴趣的可以看以下推导过程:
通过联合逆转录PCR和荧光PCR技术,则衍生出实时荧光逆转录聚合酶链式反应(realtime reverse transcription PCR, qRT-PCR)技术,由此可以对单链RNA进行定量检测。
(一)判定标准
(二)影响检测结果的若干因素
1、初始模板数量
2、引物和探针
3、dNTP
4、酶
(二)假阳性与假阴性
1、假阳性
2、假阴性













请先 登录后发表评论 ~